5月1日,东北农业大学生命科学学院姜巨全教授课题组、中国科学院物理研究所姜道华研究员课题组和北京大学药学院黄卓研究员课题组在国际著名学术期刊《自然•通讯》(Nature Communications,IF 16.6 )上合作发表题为“Structural mechanism of voltage-gated sodium channel slow inactivation”的研究论文。东北农业大学生命科学学院博士研究生陈慧文和中国科学院物理研究所硕士研究生夏崭忆及北京大学硕士研究生董洁为本研究论文的共同第一作者,姜巨全教授、姜道华研究员、黄卓研究员为共同通讯作者,东北农业大学为第一署名单位。

文章封面截图
在哺乳动物中,电压门控钠通道负责启动和传播动作电位,在生物神经信号传导、肌肉收缩、神经递质释放等多种生理进程中发挥至关重要的作用。哺乳动物的电压门控钠通道被认为是起源自细菌和浮游藻类的电压门控钠通道。尽管前者与后者存在结构多样性,但是所有物种的电压门控钠通道均存在三种状态:静息状态(resting state)(图2a)、激活状态(activated state)(图2b)和失活状态(inactivated state)(图2c&d)。电压门控钠通道通过以上三种状态的改变,实现或阻止钠离子进入细胞,从而调节着生命活动。哺乳动物的电压门控钠通道通常会在几亳秒内快失活,即采用一个保守的IFM基序作为一个疏水性闩锁,以变构方式关闭激活门。相比之下,同源四聚体的细菌电压门控钠通道缺乏IFM基序,也没有快失活机制,而采用具有数百毫秒内的慢失活机制。

NavEh的失活机制模型
赫氏圆石藻(Emiliania huxleyi),又称作颗石藻、海洋球石藻,是一种广泛存在于不同温度和盐环境的浮游真核微生物。作为海洋和咸水水域重要的生物类群,在全球性或区域性气候、物质循环和海洋环境等方面有着重要的影响,同时因其存在于高盐环境必然进化出独特的耐盐机制。早期在赫氏圆石藻(E. huxleyi)中发现同源四聚体钠通道(NaVEh),该通道的及时关闭(也称失活)可阻挡过多的钠离子进入细胞,这是单细胞浮游真核微生物抵御外界高盐环境的一种独特的方式,但该通道在什么条件下失活,失活机制是什么,是否同哺乳动物一样受到快失活和慢失活两种机制的共同调节,尚不清楚。在前期工作中,姜巨全教授作为参与者之一,陈慧文博士生作为共同第一作者,与姜道华研究员课题组等合作研究发现并揭示NaVEh存在全新的N型快失活门控机制,且通过NaVEh的N端螺旋直接插入并阻断已激活的中央腔门孔,从而使其实现快失活(图2c)(N-type fast inactivation of a eukaryotic voltage-gated sodium channel. Nature Communications 13: 2713)。这不同于以往哺乳动物的电压门控钠通道基于保守IFM基序作为疏水性门锁的快失活机制。
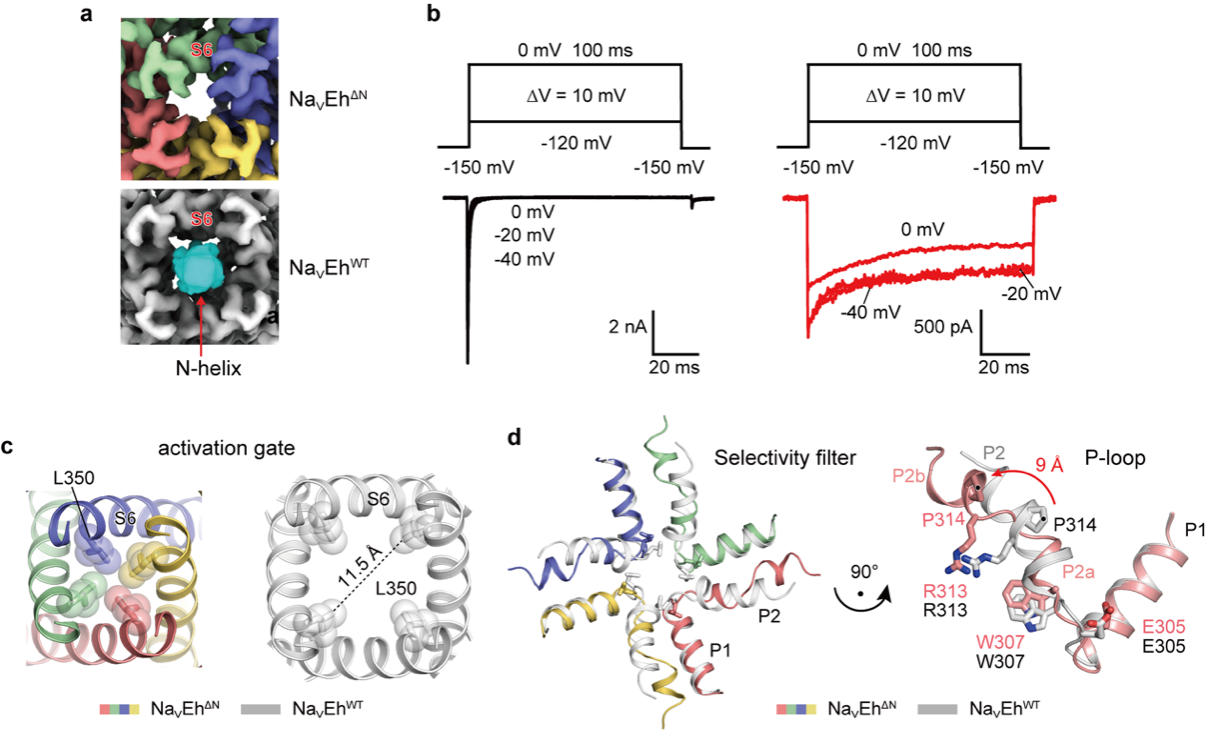
NavEh慢失活的结构机制
本研究旨在进一步分析NaVEh的N端螺旋作用,却意外发现NaVEh通道同样也存在慢失活,即将NaVEh N端螺旋去除后通道进入慢失活状态(图2d)。为探究NaVEh的慢失活特性,本研究利用单颗粒冷冻电镜技术解析NaVEh蛋白去除N端快失活元件的潜在慢失活电镜结构NaVEhΔN,从解析的NaVEhΔN结构中可知虽然缺少了堵在中央腔门孔的N端螺旋(图3a),通道无法进入快失活(3b),但该通道的中央腔门孔相比于NaVEhWT更狭窄(图3c)无法通过钠离子,同时选择性过滤器(SF)向外侧更加的扩张,也无法招募钠离子,(图3d),因此通道进入慢失活状态。该项研究成果在前期揭示NaVEh N型快失活门控机制基础上,报道了NaVEh N端螺旋截短突变体NaVEhΔN慢失活的结构机制。作为介于细菌与哺乳动物进化的过渡阶段,真核微生物赫氏圆石藻(E. huxleyi)的钠离子通道NaVEh同时具有快失活和慢生活门控机制,其重要科学价值在于对电压门控钠通道从细菌慢失活机制向哺乳动物快失活机制过渡的进化机制具有重要启示作用。同时,作为广泛存在于不同高盐环境的海洋微生物,赫氏圆石藻(E. huxleyi)的钠离子通道NaVEh同时存在快失活和慢失活门控机制,暗示其可能通过某种独特的钠通道活性调控机制介导两种失活机制的交替开启,从而实现其适应不同高盐环境的耐盐机制。该机制极有可能代表海洋微生物耐盐的主要机制之一。
该项研究是我校在“双一流”建设中突出加强基础学科建设,在生物学基础研究领域取得的又一项创新成果。研究得到国家自然科学基金、科技创新2030重大项目、华中科技大学学术前沿青年项目、宁夏回族自治区重点研发等项目资助。中国科学院生物物理研究所生物成像中心为本研究提供了设备和技术支持。

本研究第一作者陈慧文博士
陈慧文为我校生命科学学院2019级博士生,目前在中科院物理所攻读博士后,主要从事膜蛋白结构与功能研究,熟练掌握蛋白纯化、冷冻制样、冷冻电镜收集、数据处理、结构解析、模型搭建等核心技术,具有扎实的理论基础,分别以第一作者,共同第一作者(排名第二)和共同第一作者(排名第四)在Nature Communications发表研究论文3篇。
姜巨全教授长期从事嗜/耐盐微生物盐碱适应机制并重点关注Na+转运有关的膜蛋白结构生物学及其分子转运机制以及嗜/耐盐微生物-作物协同修复与高效利用盐碱地技术体系集成、示范与推广等研究工作,是Nature Communications等10余个期刊审稿专家,中国微生物学会农业微生物专业委员会委员,黑龙江省微生物学会常务理事;在Nature Communications(2篇)、Journal of Molecular Biology等期刊以第一或通讯作者发表论文27篇,第一完成人授权国家发明专利9项,主编教材3部,副主编教材1部,主持各类科研项目20余项,其中国家自然科学基金6项(联合基金重点1项,面上4项,青年基金1项)。
文章链接:https://www.nature.com/articles/s41467-024-48125-3