哺乳动物的第一次细胞命运决定为整个胚胎发育奠定基础,是发育生物学领域最基础、最核心的科学问题之一。自从2007年Nature上首次报道由CARM1催化建立的H3R26me可以作为4-细胞单卵裂球异质性的标志物 [1]以来,越来越多的证据表明CARM1的分子异质性在小鼠第一次细胞命运决定中起着关键作用——通过CARM1的正调控,SOX2/OCT4-SOX21轴推动卵裂球向内细胞团命运发展[2-4],而通过CARM1的负调控,BAF155-keritin-CDX2轴推动卵裂球向滋养外胚层命运发展[5]。2018年,两篇Cell背靠背的研究论文证明了LincGET和paraspeckle可以通过调控CARM1影响第一次细胞命运决定[6, 7]。然而,我们对于CARM1的分子异质性究竟是如何建立的,仍然知之甚少。这仍然是一个待解决的谜题。
2024年4月24日,多单位研究人员紧密合作,在Nature Structural & Molecular Biology 发表题为“Alternative splicing of CARM1 regulated by LincGET-guided paraspeckles biases the first cell fate in mammalian early embryos”的研究论文,通过对大量RNA-seq数据的分析,他们发现在小鼠2-细胞和4-细胞样本中,Carm1存在明显的异常外显子跳跃剪接现象。进一步的研究证实,CARM1的分子异质性来源于外显子跳跃剪接的异质性,而与转录水平无关。机制研究发现,LincGET组装的paraspeckle与splicing speckle竞争性结合Carm1基因座, 从而导致Carm1 可变剪接的分子异质性,最终造成CARM1蛋白水平的分子异质性,为第一次细胞命运决定奠定了分子基础。该研究不仅阐明了小鼠第一次细胞命运决定中分子异质性形成的机制,还证明了亚细胞核结构在细胞决策中的竞争性参与。这项工作为早期胚胎发育和细胞命运决定等基础研究提供了新的见解和研究方向。
为了揭示小鼠2-细胞至4-细胞时期CARM1分子异质性形成的机制,研究人员对公共数据库中的小鼠早期胚胎样本、细胞/组织样本的RNA-seq数据进行了详细的分析。令人惊讶的是,他们发现了一个在小鼠2-细胞和4-细胞中非常特异的现象——编码CARM1核心功能域的外显子3至外显子6存在非常明显且特异的异常外显子跳跃剪接现象(图1)。这一发现为进一步研究CARM1的分子异质性建立机制提供了重要线索。
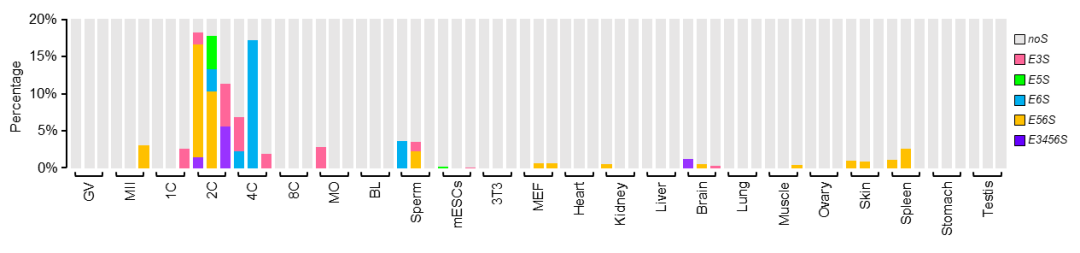
图1. Carm1 外显子3至6跳跃剪接在小鼠2-细胞至4-细胞期是特异的
随后,研究人员采用单细胞SPAR-seq、单细胞qPCR,对Carm1 外显子3至6跳跃剪接以及转录水平在小鼠2-细胞和4-细胞卵裂球中的异质性进行了深入分析。他们的结果表明,CARM1的分子异质性主要来源于外显子3至6的跳跃剪接,而与转录水平无关(图2)。这一发现揭示了CARM1分子异质性形成的新机制。
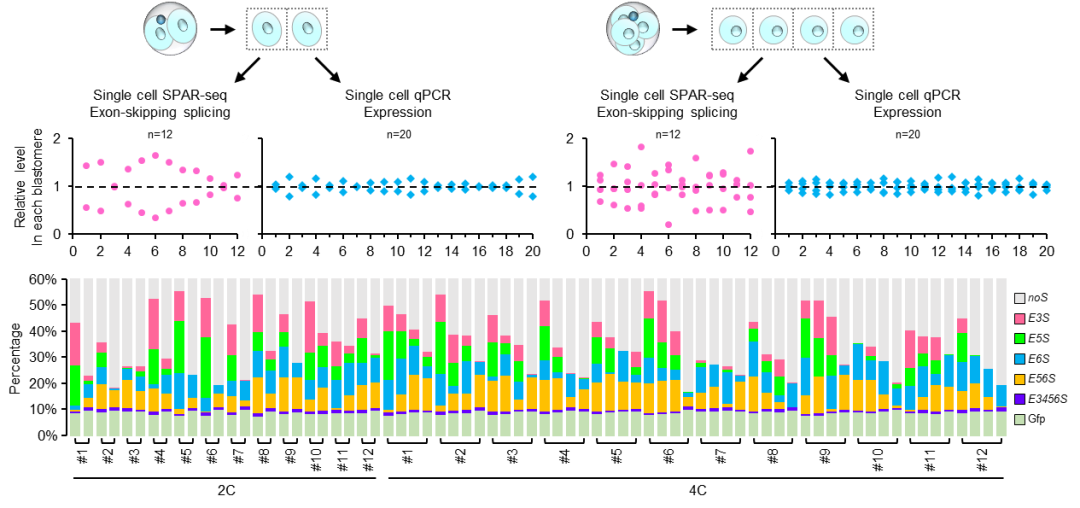
图2. Carm1 外显子3至6跳跃剪接在小鼠2-细胞至4-细胞期是异质性的
为了进一步揭示CARM1可变剪接异质性形成的机制,研究人员对参与可变剪接调控以及细胞命运决定的LincGET和亚细胞核结构paraspeckle进行了深入研究。他们发现,LincGET参与早期胚胎特异的paraspeckle的组装,并通过与HNRNPU相互作用,将paraspeckle定位到Carm1的基因座上,从而抑制了Carm1的外显子跳跃剪接。此外,通过对Carm1内含子序列的分析,研究人员还发现PCBP1参与的splicing speckle 对Carm1的外显子跳跃剪接起到特异性的促进作用。换句话说,LincGET参与的paraspeckle与PCBP1参与的splicing speckle之间存在竞争性,相互拮抗地调控Carm1的外显子跳跃剪接,决定了Carm1可变剪接水平的异质性(图3)。这一发现为深入理解CARM1分子异质性的形成机制提供了新的理论。
进一步的研究证实了Carm1可变剪接水平的异质性造成了CARM1蛋白水平的分子异质性。研究人员还证明通过过表达PCBP1增强Carm1可变剪接水平的异质性,能够促使卵裂球向滋养外胚层命运发展。该研究揭示了可变剪接在调控小鼠第一次细胞命运决定中的重要作用机制,对于我们深入理解细胞命运决定和发育过程中的剪接调控具有重要的意义。
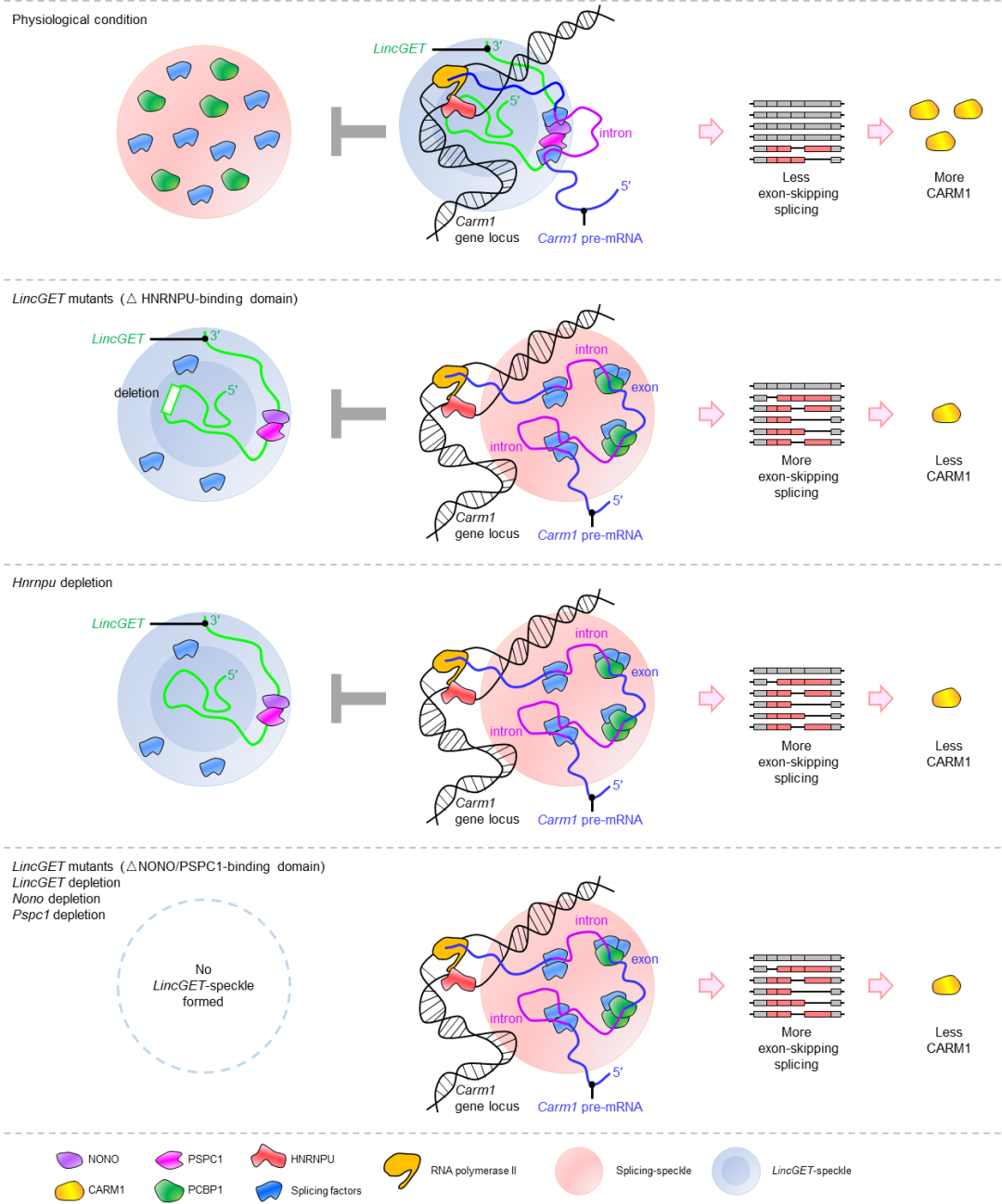
图3. Carm1 外显子跳跃剪接造成CARM1的分子异质性
东北林业大学刘玉胜教授、中科院动物所周琪院士、中科院动物所李伟研究员、中科院动物所王乐韵博士(现为厦门大学教授)与东北农业大学王加强教授为本文的共同通讯作者,东北农业大学王加强教授为本文第一作者。
原文链接:
https://www.nature.com/articles/s41594-024-01292-9
参考文献:
1. Torres-Padilla, M.E., et al., Histone arginine methylation regulates pluripotency in the early mouse embryo. Nature, 2007. 445(7124): p. 214-218.
2. Plachta, N., et al., Oct4 kinetics predict cell lineage patterning in the early mammalian embryo. Nat Cell Biol, 2011. 13(2): p. 117-23.
3. Goolam, M., et al., Heterogeneity in Oct4 and Sox2 Targets Biases Cell Fate in 4-Cell Mouse Embryos. Cell, 2016. 165(1): p. 61-74.
4. White, M.D., et al., Long-Lived Binding of Sox2 to DNA Predicts Cell Fate in the Four-Cell Mouse Embryo. Cell, 2016. 165(1): p. 75-87.
5. Lim, H.Y.G., et al., Keratins are asymmetrically inherited fate determinants in the mammalian embryo. Nature, 2020.
6. Hupalowska, A., et al., CARM1 and Paraspeckles Regulate Pre-implantation Mouse Embryo Development. Cell, 2018. 175(7): p. 1902-1916 e13.
7. Wang, J., et al., Asymmetric Expression of LincGET Biases Cell Fate in Two-Cell Mouse Embryos. Cell, 2018. 175(7): p. 1887-1901 e18.
内容为【iNature】公众号原创,
来源于【iNature】